插入 CONTOUR®PLUS 测试条,之后血糖仪将会打开。
CONTOUR®PLUS ELITE
为何选择 CONTOUR®PLUS ELITE?
只需要3个步骤,您就可以得到高精准确1的结果。

非常简单易用的系统
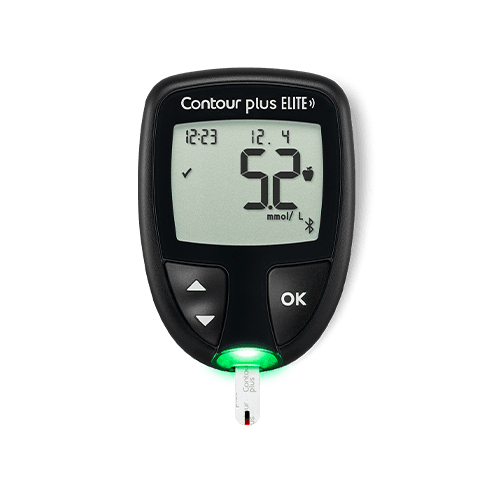
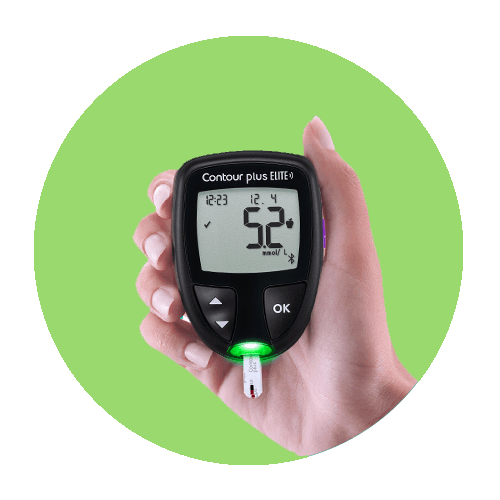
您需要的仪器2。简易读取:大字体数字展示。简单易用:大型橡胶按钮。不需要初始设置。* 平均数的个性化目标范围。

探索smartLIGHT®功能可让您更容易地理解血糖水平数3
smartLIGHT®使其更快、更容易地显示血糖数据,使用彩色灯光清楚地识别读数是否高于标准、或者低于您的目标范围。†

CONTOUR®PLUS ELITE系统已被证明能提供高度准确的结果1
CONTOUR®PLUS ELITE系统的可信赖高准确性可帮助您作出自我管理方面的决策1

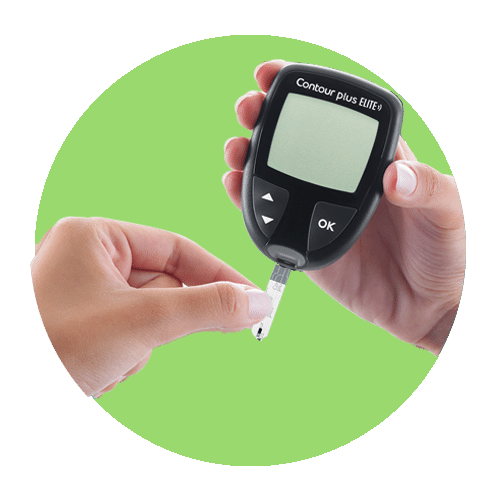
Second-Chance® 采样技术 有助于节省测试条4
CONTOUR®PLUS ELITE有一个60秒的倒计时屏幕,如果第一个样本不足,病人可以在同一条测试条上滴加更多的血液。

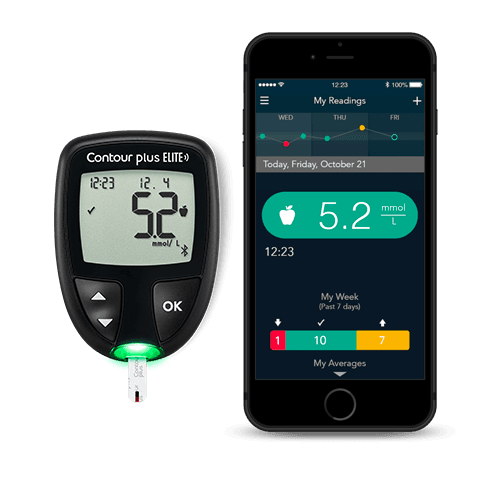
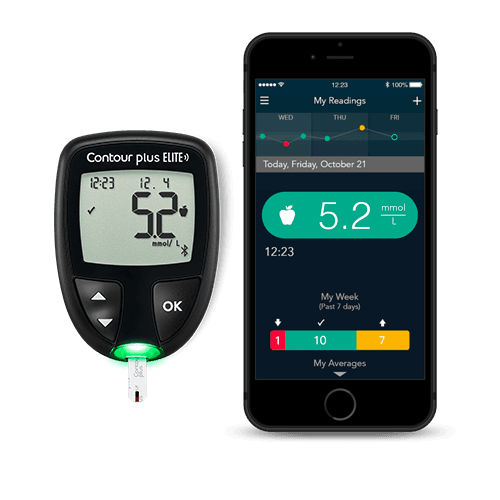
连接免费的CONTOUR®DIABETES 应用程序
免费的CONTOUR®DIABETES应用程序可用于支持糖尿病患者的自我管理,增加对结果的洞察力和意义
简单易用: 在应用程序和血糖仪之间实现自由自动同步,可将血糖读数上传到电子日记
简易明白: 我的血糖趋势将帮助病人识别血糖结果的趋势,并显示潜在原因的通知
易于共享: 血糖日记可以在与医疗保健专业人员预约之前、或预约期间分享
CONTOUR®DIABETES 应用采用适当的保护措施来确保您的个人数据的处理安全且符合适用法律的要求。
使用方法*
只需要3个步骤,您就可以得到高精准确1的结果。
配套使用
Please consult your healthcare professional for interpretation of result and diagnosis.
†在改变您的目标范围之前,请您一定要咨询你的保健医生。
*使用前,请查看 CONTOUR®PLUS ELITE 用户指南了解完整说明。
**在兼容的 Android 或 iOS 设备上。有关兼容操作系统的列表,请访问 compatibility.contourone.com
1. Klaff L et al. J Diabetes Sci Technol. November 2020. doi:10.1177/1932296820974348.
2. Research partnership Ascensia Diabetes Care Market Research, March 17. 100 patients in Canada, Germany, and US.
3. Smartson online survey, Sweden 2017. 352 respondents: People with type 1 and type 2 diabetes, over 18 years old, who tested at least 4-7 times a day. Participants received free meter and tests strips. Survey funded by Ascensia Diabetes Care.
4. Richardson JM et al. Clinical Relevance of Reapplication of Blood Samples During Blood Glucose Testing. Poster presented at the 20th Annual Diabetes Technology Meeting (DTM); November 12-14, 2020.
Registered under Act 737 and MDA registration no IVDC 1946922-95630
MD Advertisement approval number: MDAMD 0180/2023